Ágora dixital
En esta experiencia trabajaremos el concepto de concentración de una disolución a partir del estudio del proceso de osmosis con unos ositos de gominola.

Cesta de materiales
Presiona en los puntos interactivos de la imagen.
Manos a la obra
- Paso 1
-
- Se etiquetan tres vasos como "Control", "Agua" y "Azúcar".
- Se etiquetan tres vasos como "Control", "Agua" y "Azúcar".
- Paso 2
-
- Se añaden 150 mL (o 150 g) de agua a los vasos etiquetados como "Agua" y como "Azúcar".
- Paso 3
-
- En una balanza, se pesan 55 g de azúcar y se añaden, cuidadosamente, al vaso etiquetado como "Azúcar".
- Se remueve la mezcla hasta total disolución.
- Paso 4
-
- Se introduce un osito de gominola en cada uno de los tres vasos.
- Paso 5
-
- Se tapan y se dejan en reposo durante 12 horas.
- Paso 6
-
- Pasado ese tiempo, se extraen los ositos de gominola de los vasos y se dejan secar sobre papel absorbente. Finalmente, se comparan los resultados.
Imaxe
- Paso 7
-
- Se repite el proceso, respetando las cantidades empleadas previamente, pero, ahora, añadiendo sal en uno de los vasos, en lugar de azúcar.
Imaxe
Tips docentes
Los tips docentes son pequeñas ayudas para desarrollar la estrategia educativa de forma adecuada.
¿Qué es la osmosis?
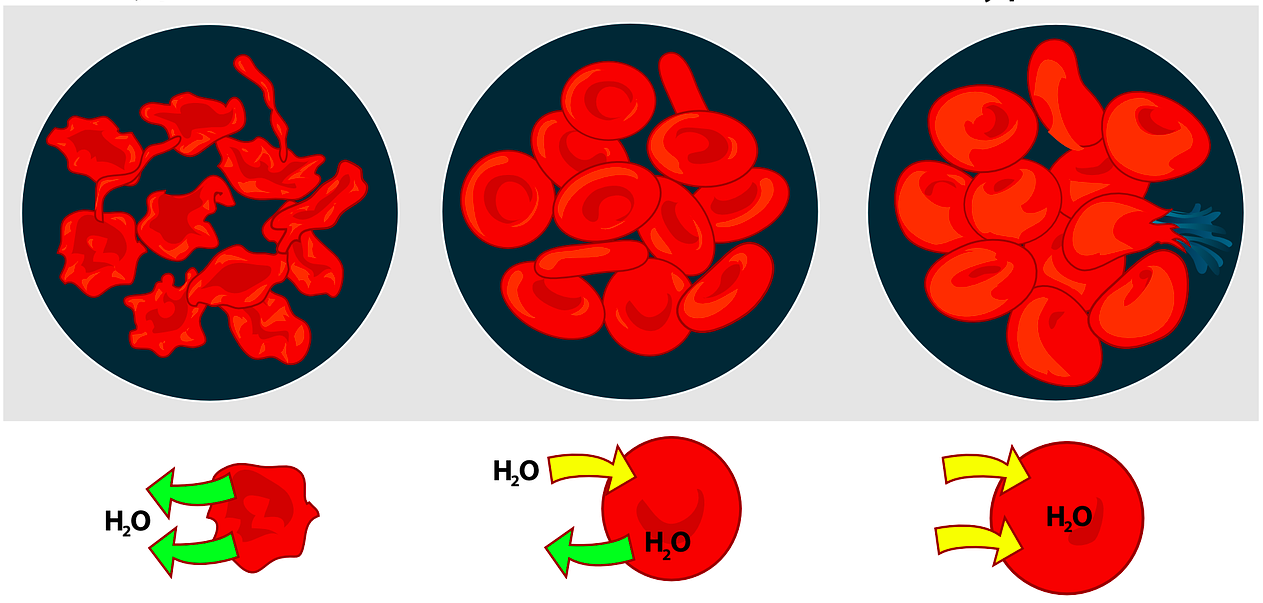
La osmosis es un proceso de difusión en el que, al poner en contacto dos disoluciones acuosas con distinta concentración de soluto a través de una membrana semipermeable (que deja pasar las moléculas de disolvente, pero no las de soluto), las moléculas de agua viajan desde la disolución más diluida a la más concentrada, cesando el movimiento cuando las dos concentraciones se igualan. Este fenómeno tiene lugar, por ejemplo, en nuestras células de manera constante, pues la membrana plasmática que las recubre es una membrana semipermeable. Así, al ingerir comida muy salada, incrementamos notablemente la concentración de soluto en el medio extracelular, provocando la deshidratación de las células, que puede ser más o menos intensa.
¿Qué es la molaridad?
La concentración es un concepto que empleamos para indicar la cantidad de soluto contenido en una determinada cantidad de disolvente o de disolución. Se pueden emplear maneras muy diversas de expresar la concentración de una disolución. Una de las más importantes para disoluciones líquidas, y que se emplea en este trabajo, es la concentración molar o molaridad, que relaciona el número de moles de soluto (y, por lo tanto, el número de moléculas) con el volumen, en litros, de disolución. Para trabajar la correcta asimilación de este concepto se puede emplear el siguiente laboratorio virtual PhET (https://phet.colorado.edu/sims/html/molarity/latest/molarity_all.html?locale=eres):
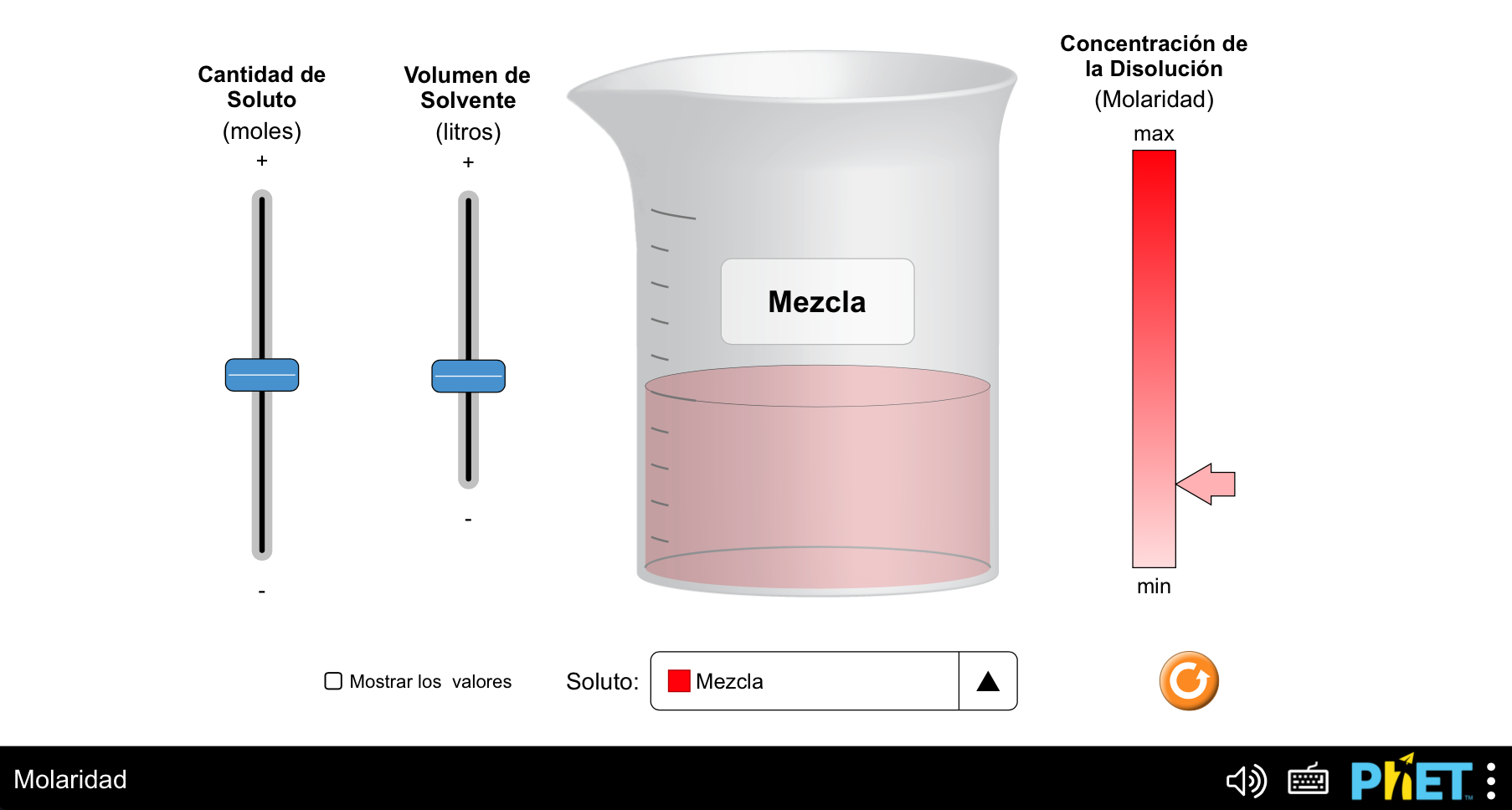
En este caso, tendremos en cuenta los siguientes aspectos:
a) En todos los experimentos trabajaremos con ositos Haribo del mismo color, y, a ser posible, con vasos exactamente iguales, con el objetivo de alterar el menor número de variables posible de un experimento a otro. De este modo, los cambios observados en los resultados podrán ser atribuidos a la variable objeto de estudio.
b) En cada experimento, reservaremos un osito Haribo, que introduciremos en un vaso vacío, y que taparemos del mismo modo que los demás. Este osito actuará como control, y servirá para analizar los resultados obtenidos, comparando su tamaño con el de los ositos sumergidos en distintas disoluciones.
c) Lleva un tiempo disolver por completo el azúcar y la sal, pero es importante que el resultado final sean dos disoluciones homogéneas, pues sólo así podremos conocer con exactitud cuál es la concentración de soluto. En el caso de la sal, estamos trabajando en cantidades próximas a la saturación, por lo que puede suceder que no toda la sal se disuelva en agua. Intentaremos, de todos modos, que dicha cantidad sea la menor posible.
d) Una vez obtenido y analizado el resultado en la prueba con azúcar (paso 6 del apartado 'Manos a la obra'), se le podrá pedir al alumnado que, de cara al experimento con sal, elabore una hipótesis. Puede, también, establecerse, en este punto, un debate alrededor de las siguientes cuestiones: ¿se obtendrá el mismo resultado en el experimento con sal? ¿Se obtendrá un resultado distinto? ¿El cloruro de sodio y la sacarosa son el mismo tipo de compuesto? ¿Tienen la misma masa molar? ¿Qué les ocurre cuando se disuelven en agua?
e) Una vez concluido el experimento, se le puede proponer al alumnado que intente explicarlo a partir de los conceptos teóricos sobre la osmosis y la concentración molar introducidos al principio de la sesión.
f) El tiempo del experimento se puede alterar, pero a partir de las 24 horas los ositos sumergidos en agua empiezan a desintegrarse, lo que dificulta el análisis de los resultados obtenidos.
g) Se puede realizar el experimento de manera cuantitativa si se dispone de una balanza con una precisión mínima de 0,1 g. Así, se puede comparar la masa inicial del osito y la masa final, y calcular, incluso, el porcentaje de incremento de masa en los distintos experimentos.
ANÁLISIS DE LOS RESULTADOS OBTENIDOS
Si el experimento se realiza correctamente, se observará lo siguiente:
i) El osito introducido en agua aumenta considerablemente su volumen.
ii) El osito introducido en agua y azúcar aumenta de volumen, pero menos que el sumergido en agua.
iii) El osito introducido en agua y sal casi no incrementa, o incluso disminuye, de volumen.

La osmosis provoca que las concentraciones de las disoluciones en contacto a través de una membrana semipermeable, en este caso la gelatina que recubre el osito, se igualen. Cuando esto ocurre, decimos que tenemos la misma cantidad de soluto por unidad de volumen. A través de la membrana sólo pueden circular las moléculas de disolvente (agua), y no así las de soluto. De este modo, la manera de igualar las concentraciones es que el agua fluya desde la disolución más diluida a la más concentrada. Es importante tener en cuenta que en la osmosis no se diferencia entre un soluto u otro. Hablamos, en este caso, de solutos, en general, para referirnos a todo lo que no sea agua, aunque nos centramos en el azúcar y en la sal por ser, claramente, los mayoritarios, pudiendo despreciar el efecto debido a las demás sustancias. Así, tenemos:
i) El agua del grifo prácticamente no contiene solutos disueltos (y, mucho menos, azúcar). Por eso, el medio interno del osito tendrá una concentración de soluto muy superior a la que hay en el agua. De este modo, el agua fluye de fuera hacia adentro del osito para que su concentración de soluto disminuya (y se asemeje a la del agua), lo que hace que el osito aumente mucho su volumen.
ii) La disolución de azúcar en agua tiene una concentración de soluto muy superior a la que tiene el agua pura. La diferencia, por tanto, de concentración con el medio interno del osito es más moderada. Como la disolución de azúcar en agua es un medio hipotónico con respeto al interior del osito (que tiene mucha cantidad de azúcar contenida en muy poco volumen de agua), el agua fluye del medio más diluido al más concentrado, haciendo que el osito aumente de volumen.
iii) La disolución de sal en agua tiene una concentración de soluto superior o muy semejante a la del interior del osito. Es decir, que añadiendo la misma cantidad de azúcar que de sal, tenemos muchas más moléculas de sal que de azúcar en la disolución (el volumen de las disoluciones es el mismo en todos los casos). Esto ocurre porque "una molécula de NaCl (cloruro de sodio)" tiene una masa muy inferior a la de una molécula de sacarosa (C12H22O12). Además, el NaCl es un compuesto iónico, lo que hace que, en agua, los átomos de sodio y los átomos de cloro se disocien, dando una cantidad de partículas de soluto muy superior a la que cabría esperar si el compuesto hubiera sido covalente (como la sacarosa).
Tu clase en un clic
Implementa esta microsecuencia en tu aula Moodle (Descarga disponible en gallego o castellano).
|
Imaxe
 |
Imaxe
 |
