Ágora dixital
Nesta experiencia traballaremos o concepto de concentración dunha disolución a partir do estudo do proceso de osmose cuns osiños de gominola.

Cesta de materiais
Preme nos puntos interactivos da imaxe.
Mans á obra
- Paso 1
-
- Etiquétanse tres vasos como "Control", "Auga" e "Azucre".
- Etiquétanse tres vasos como "Control", "Auga" e "Azucre".
- Paso 2
-
- Engádense 150 mL (ou 150 g) de auga aos vasos etiquetados como "Auga" e como "Azucre".
- Paso 3
-
- Nunha balanza, pésanse 55 g de azucre e engádense, coidadosamente, ao vaso etiquetado como "Azucre".
- Remóvese ata total disolución.
- Paso 4
-
- Introdúcese un osiño de gominola en cada un dos tres vasos.
- Paso 5
-
- Tápanse e déixanse en repouso durante 12 horas.
- Paso 6
-
- Pasado ese tempo, extráense os osiños de gominola dos vasos e déixanse secar sobre papel absorbente. Finalmente, compáranse os resultados.
Imaxe
- Paso 7
-
- Repítese o proceso, respectando as cantidades empregadas previamente, pero, agora, engadindo sal nun dos vasos, en lugar de azucre.
Imaxe
Tips docentes
Os tips do profesorado son pequenas axudas para desenvolver a estratexia educativa de forma adecuada.
Que é a osmose?
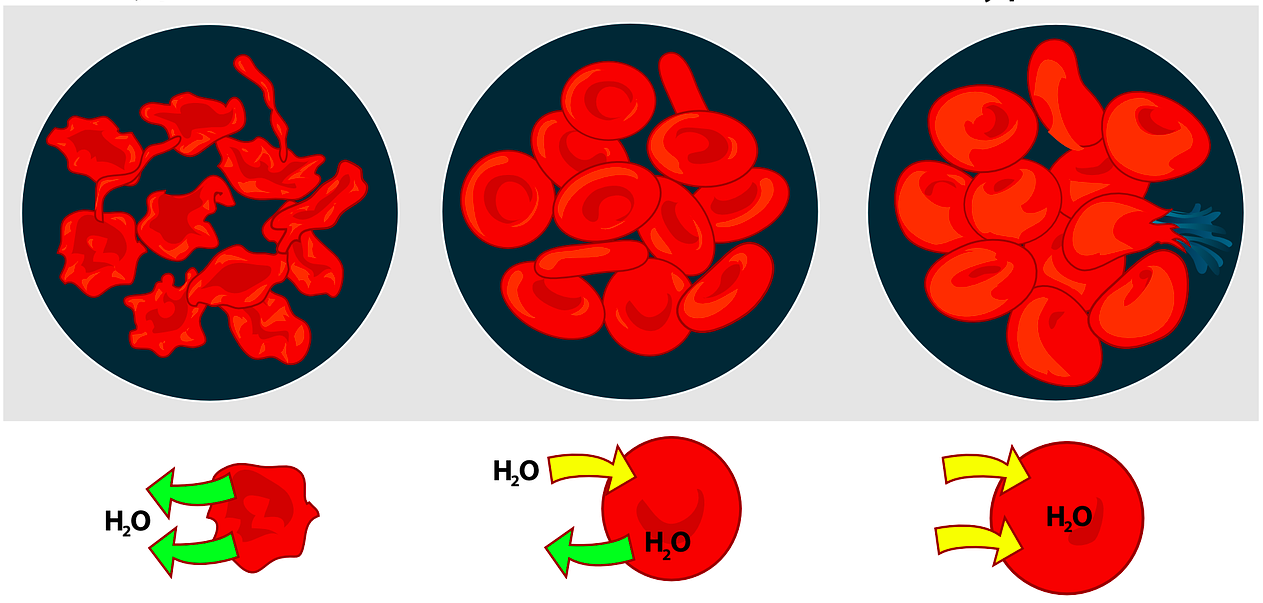
A osmose é un proceso de difusión no que, ao poñer en contacto dúas disolucións acuosas con distinta concentración de soluto a través dunha membrana semipermeable (que deixa pasar as moléculas de disolvente, pero non as de soluto), as moléculas de auga viaxan desde a disolución máis diluída á máis concentrada, cesando o movemento cando ámbalas dúas concentracións se igualan. Este fenómeno ten lugar, por exemplo, nas nosas células de maneira constante, pois a membrana plasmática que as recobre é unha membrana semipermeable. Así, ao inxerirmos comida moi salgada, incrementamos notablemente a concentración de soluto no medio extracelular, provocando a deshidratación das células, que pode ser máis ou menos intensa.
Que é a molaridade?
A concentración é un concepto que empregamos para indicar a cantidade de soluto contido nunha determinada cantidade de disolvente ou de disolución. Pódense empregar maneiras moi diversas de expresar a concentración dunha disolución. Unha das máis importantes para disolucións líquidas, e que se emprega neste traballo, é a concentración molar ou molaridade, que relaciona o número de moles de soluto (e, polo tanto, o número de moléculas) co volume, en litros, de disolución. Para traballar a correcta asimilación deste concepto pódese empregar o seguinte laboratorio virtual PhET (https://phet.colorado.edu/sims/html/molarity/latest/molarity_all.html?locale=es):
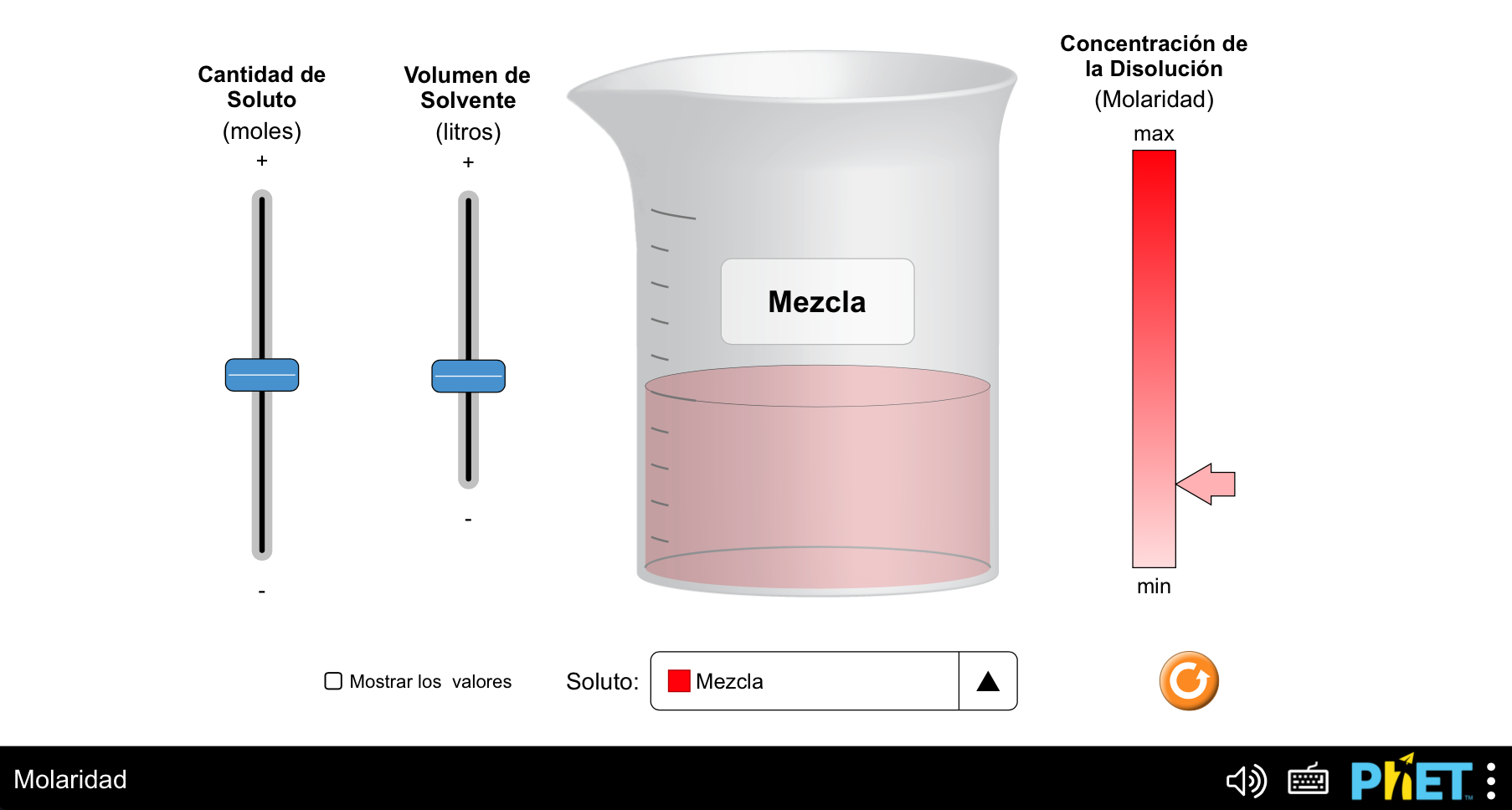
Neste caso, teremos en conta os seguintes aspectos:
a) En todos os experimentos traballaremos con osiños Haribo da mesma cor, e, a ser posible, con vasos exactamente iguais, co obxectivo de alterar o menor número de variables posible dun experimento a outro. Deste xeito, os cambios observados nos resultados poderán ser atribuídos á variable obxecto de estudo.
b) En cada experimento, reservaremos un osiño Haribo, que introduciremos nun vaso baleiro, e que taparemos do mesmo xeito ca os demais. Este osiño actuará como control, e servirá para analizar os resultados obtidos, comparando o seu tamaño co dos osiños somerxidos en distintas disolucións.
c) Leva un tempo disolver por completo o azucre e o sal, pero é importante que o resultado final sexan dúas disolucións homoxéneas, pois só así poderemos coñecer con exactitude cal é a concentración de soluto. No caso do sal, estamos traballando en cantidades próximas á saturación, polo que pode suceder que non todo o sal se disolva en auga. Intentaremos, de tódolos xeitos, que dita cantidade sexa a menor posible.
d) Unha vez obtido e analizado o resultado na proba con azucre (paso 6 do apartado 'Mans á obra'), poderáselle pedir ao alumnado que, de cara ao experimento con sal, elabore unha hipótese. Pode, tamén, establecerse, neste punto, un debate arredor das seguintes cuestións: obterase o mesmo resultado no experimento con sal? Obterase un resultado distinto? O cloruro de sodio e a sacarosa son o mesmo tipo de composto? Teñen a mesma masa molar? Que lles ocorre cando se disolven en auga?
e) Unha vez concluído o experimento, pódeselle propoñer ao alumnado que intente explicalo a partir dos conceptos teóricos sobre a osmose e a concentración molar introducidos ao principio da sesión.
f) O tempo do experimento pódese alterar, pero a partir das 24 horas os osiños somerxidos en auga empezan a desintegrarse, o que dificulta a análise dos resultados obtidos.
g) Pódese realizar o experimento de xeito cuantitativo se se dispón dunha balanza cunha precisión mínima de 0,1 g. Así, pódese comparar a masa inicial do osiño e a masa final, e calcular, mesmo, a porcentaxe de incremento de masa nos distintos experimentos.
ANÁLISE DOS RESULTADOS OBTIDOS
Se o experimento se realiza correctamente, observarase o seguinte:
i) O osiño introducido en auga aumenta considerablemente o seu volume.
ii) O osiño introducido en auga e azucre aumenta de volume, pero menos ca o somerxido en auga.
iii) O osiño introducido en auga e sal case non incrementa, ou mesmo diminúe, de volume.

A osmose provoca que as concentracións das disolucións en contacto a través dunha membrana semipermeable, neste caso a xelatina que recobre o osiño, se igualen. Cando isto ocorre, dicimos que temos a mesma cantidade de soluto por unidade de volume. A través da membrana só poden circular as moléculas de disolvente (auga), mais non as de soluto. Deste xeito, a maneira de igualar as concentracións é que a auga flúa desde a disolución máis diluída á máis concentrada. É importante ter en conta que na osmose non se diferenza entre un soluto ou outro. Falamos, neste caso, de solutos, en xeral, para referírmonos a todo o que non sexa auga, aínda que nos centramos no azucre e no sal por seren, claramente, os maioritarios, podendo desprezar o efecto debido ás demais substancias. Así, temos:
i) A auga da billa practicamente non contén solutos disoltos (e, moito menos, azucre). Por iso, o medio interno do osiño terá unha concentración de soluto moi superior á que hai na auga. Deste xeito, a auga flúe de fóra cara adentro do osiño para que a súa concentración de soluto diminúa (e se asemelle á da auga), o que fai que o osiño aumente moito o seu volume.
ii) A disolución de azucre en auga ten unha concentración de soluto moi superior á que ten a auga pura. A diferenza, pois, de concentración co medio interno do osiño é máis moderada. Como a disolución de azucre en auga é un medio hipotónico con respecto ao interior do osiño (que ten moita cantidade de azucre contida en moi pouco volume de auga), a auga flúe do medio máis diluído ao máis concentrado, facendo que o osiño aumente de volume.
iii) A disolución de sal en auga ten unha concentración de soluto superior ou moi semellante á do interior do osiño. É dicir, que engadindo a mesma cantidade de azucre ca de sal, temos moitas máis moléculas de sal ca de azucre na disolución (o volume das disolucións é o mesmo en todos os casos). Isto ocorre porque "unha molécula de NaCl (cloruro de sodio)" ten unha masa moi inferior á dunha molécula de sacarosa (C12H22O12). Ademais, o NaCl é un composto iónico, o que fai que, en auga, os átomos de sodio e os átomos de cloro se disocien, dando unha cantidade de partículas de soluto moi superior á que cabería esperar se o composto fora covalente (coma a sacarosa).
A túa clase nun clic
Implementa esta microsecuencia na túa aula Moodle (Descarga dispoñible en galego ou castelán).
|
Imaxe
 |
Imaxe
 |
